'Ch 4 : Three Major Classes of chemical Reaction 세 종류의 주요 화학 반응 단원'에서의 주요 개념들을 정리하였습니다.
주로 텍스트 위주로 정리하였고, 이해해 필요한 사진이나 표도 함께 첨부하여, 제가 공부하며 이해하고 해석한 순서에 따라 구성하였습니다.
혹시나 개념과 관련한 질문이 있다면 댓글로 남겨주세요. 약 2주간 시간을 할애해 정리하였으므로, 최선을 다해 답변드리겠습니다.
그럼, 시작해보겠습니다.
ㅡㅡㅡㅡㅡㅡㅡ
[개요] Ch4 는 결국 화학반응을 배우므로, 주요한 3가지 화학반응이 있다는 것을 큰 틀에서 기억해야합니다.
<주요 화학반응 3가지>
1. 침전반응
- 침전반응을 배우기 위해, 수용액(물이 용매인 용액)상의 이온 반응을 배워야하고, 이를 배우기 위해 '물'에서의 반응을 배워야 합니다.
2. 산-염기반응
- '양성자 전달'개념이 매우 중요하다는 것을 기억해야 합니다.
3. 산화-환원 반응
- 연료 전지, 베터리 등 우리나라의 주력 기술과 관련이 있고, 화학에서 매우 중요한 반응으로 여겨지고 있습니다.
4.1) 용매로서의 물의 역할과 용액의 농도
[각 개념별로 중요한 포인트들]
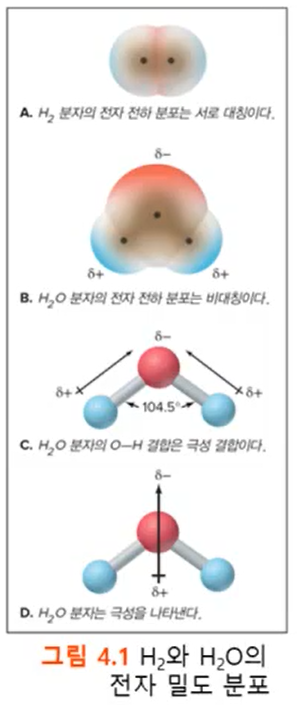
*물은 극성분자이다.
- 분자는 극성분자와 비극성분자 2가지로 나뉜다.
- 물이 극성분자가 될 수 있는 요인에는 1. 불균등 전하분포를 가지고 2. 굽은 분자모양이기 때문에 3. 분자의 전자 분포에서 차이가 나기 때문에 분자의 특정 부위가 각각 다른 전하를 가지게 되기 때문이다.
*물 속의 이온 결합 화합물
- (거의) 대부분의 이온 결합 화합물은 물에서 잘 녹는다. 그 이유는, 대부분의 이온 결합 화합물의 화합물 내 원자들의 인력보다, 물분자와 원자들의 인력이 더 강하기 때문에 물에 들어가는 즉시 물 분자가 원자들을 분해하기 때문이다.
- 용매화(solvation), 용해도(solvency)에 대한 개념도 잘 이해해야한다.
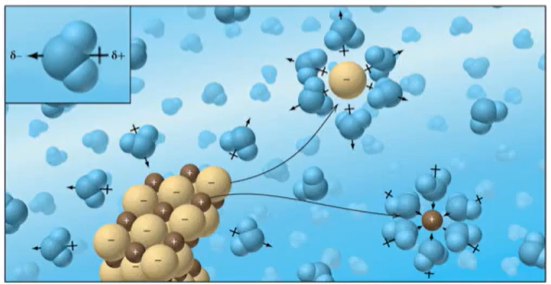
"이온 결합 화합물은 물에서 물 분자와 이온의 인력이 화합물의 이온들의 인력을 대체하기 때문에 물에서 잘 용해된다."
*전해질 electrocycle
- 이온결합화합물이 용해된 수용액은 전류가 흐른다.
- 전류가 흐르는 이유는, 용매화(분리된 이온들이 물분자로 둘러쌓인 것)된 이온들이 전기가 들어왔을 때 반대전하를 띤 전극쪽으로 이동하며 전류가 흐를 수 있기 때문이다.
- 전류가 흐르게 하는 물질을 '전해질'이라 부른다.
- 공유결합 화합물은 물에서 용해되는가?
- 대부분 되지 않지만, 공유결합 화합물 중 극성결합(이온결합물의 특징)을 지닌 공유결합 화합물은 물과 상호작용할 수 있는 극성결합의 특징 때문에 물 분자와의 인력이 유효하게 작용한다.
- 하지만 중요한 것은 "대부분의 가용성(물에 잘 녹는) 공유결합 물질은 물에 녹을 때 이온으로 분리되지 않고, 분자 그대로 남아있다"는 것이다.
- 이는 곧 '비전해질' : 전류가 잘 흐르지 않는 물질 의 특징을 지니는 요인이 된다.
- 물에 잘 용해되는 공유결합 화합물은 설탕 (C12H22O11), 에틸렌 글라이콜 (HOCH2CH2OH) - 자동차 부동액 - 이 대표적이다.
- 물에 잘 용해되지 않는 공유결합 화합물의 예로는 벤젠 (C6H6), 옥테인 (C8H18)이 대표적이다.
*몰농도 Molarity
- '농도'란 일정양의 용액(or 용매)에 녹아 있는 용질의 양을 의미한다.
- 화학에서 농도는 대표적으로 2가지가 있는데, 1. 몰동도(M), 2. 몰랄농도 (m), 둘 다 Molarity이고, 표기는 대문자와 소문자로 구분한다.
- 몰농도의 정의는 '1L당 용질의 몰수이고, 몰랄농도의 정의는 '1kg 당 용질의 몰수이다.
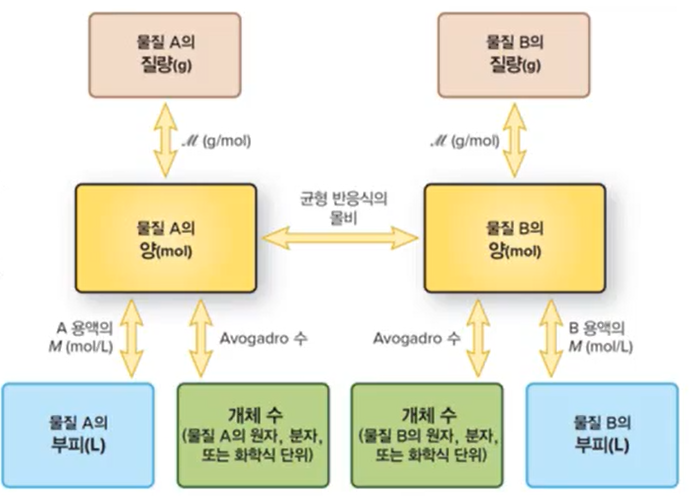
*몰농도를 통해 용질의 질량(mol, g), 물질의 수(avogadro수), 용액의 부피 등 모두 환산이 가능하다.
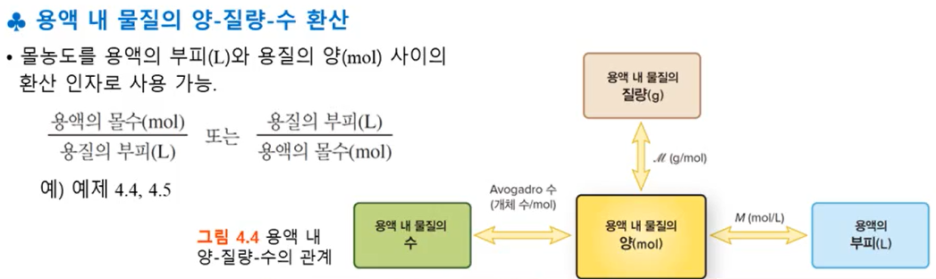
*용액의 제조와 묽힘
- 몰농도를 측정할 때는 2 가지 준비물이 필요함
- 무게를 재는 거울
- 부피 플라스크 (눈금이 있음)
- 용액 묽히기는 용매를 추가하면 묽어짐
*묽힘과 관련된 식
- MxV = 용질의 양(mol) = M'xV'
- (M, V -> 묽은 용액의 몰농도, 부피, M', V'-> 진한 용액의 몰농도, 부피)
- 즉, 몰농도 x 부피 = '용질의 양'이다. 위 식을 이용해 진한 or 묽은 용액의 몰농도 또는 부피를 계산할 수 있다.
4.2) 이온 반응의 반응식
반응식은 3 가지가 있다.
1. 분자 반응식
- 화학 반응식과 비슷, 기호에 대한 해석이 약간 달라짐 : (aq) = 물에 잘 녹는 것, (s) = 반응 후 침전된 고체, 잘 침전되는 것
2. 전체 이온 반응식
- 모든 화합물을 각각의 이온상태로 쪼개어 표기한 것
3. 알짜 이온 반응식
- 반응에 참여한 이온만 표기!
- 전체 이온 반응식에서 실제 화학적으로 변화가 일어난 것만 보여주기 위한 식이다.
- '구경꾼 이온' 이란 반응에 참여하지 않고 수용엑에 녹아있기만 한 이온을 의미하는데, 알짜 이온 반응식은 전체 이온 반응식에서 '구경꾼 이온'을 삭제한 반응식을 의미한다.
4.3) 침전반응
- 화학 반응을 통해 침전이 만들어질 수 있음
- 이 파트에서는 침전 형성을 '예측' 하는 것이 중요함
- 수용성 : 이온간의 인력보다, 이온과 물분자의 인력이 더 큼 -> 물분자에 의해 이온화합물이 분리되어 용해가 됨
- 불용성 : 이온과 물분자의 인력보다, 이온간의 인력이 더 큼 -> 물분자에 의해 분리되지 않음, 용해되지
즉, 수용성이었던 화합물이 물에 녹아서 분해되어 이온상태도 떠돌다가, 물분자와의 인력보다, 이온들 간의 인력이 크게 작용하게 되면 물에 녹지 않는 불용성의 침전물을 형성하게 된다. 사진의 표는 암기해야하는 표인데, 로직을 잘 이해하면 암기하기 용이하다. 표의 논리를 주기율표를 통해 원소의 특징으로 이해하면 된다.
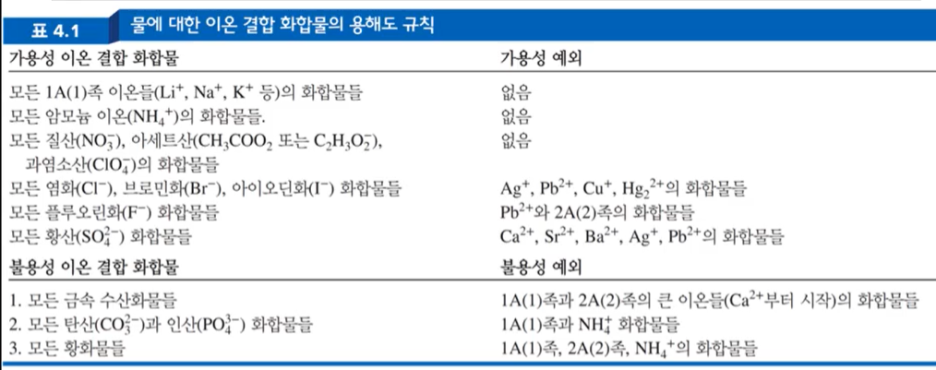
*'용해도 규칙' 표 해석
- 먼저, 가용성 이온 결합 화합물과, 가용성 예외에 대해 살펴볼 것이다. 중요한 것부터 학습하기 위해, 가용성 예외가 존재하는 염화, 브로민화, 아이오딘화 화합물 부터 살펴보자.
1. 모든 염화(Cl⁻)과 브로민화(Br⁻), 아이오딘화(I⁻) 화합물들은 그 자체로 물에 잘 녹는 가용성 화합물이다.
그러나, (오른쪽 '가용성 예외' 부분) Ag⁺, Pb²⁺, Cu⁺, Hg₂²⁺ 와 결합하게 될 경우 물에 녹지 않는 불용성 화합물이 된다.
예시를 통해 이해해보자.
Ex) AgCl을 예로 들면, 3가지 요인에 의해 불용성 화합물이 된다.
첫째, Ag 원소는 전이금속이지만 비금속에 가까운 원소이다. 따라서 AgCl은 공유결합의 성질(이온화되지 않은 안정화된 상태)을 지닌다.
둘째, Ag 원소 자체는 치밀한 결정구조를 가지기 때문에, 물 분자가 침투하기 어렵다.
셋째, H₂O 물 분자가 극성분자인 것에 비해, Ag 분자는 상대적으로 비극성에 해당한다. 따라서 물 분자와의 상호작용이 약하기 때문에 용해도가 낮다.
-> 이런 3가지 이유로, AgCl은 불용성 화합물이기 때문에, 물에 잘 녹지 않는다.
2. 모든 플루오린화 (F⁻) 화합물은 물에 잘 녹는 가용성 화합물이다.
그러나, Pb²⁺원소, 2A(2) 족의 원소 = 2+ charge를 띠고 있는 원소와 결합한 화합물은 불용성 화합물이다. Why) 왜 그럴까?
- F 원소가 (-1) 전하를 가지지만, Pb²⁺와 2A(2)족의 원소는 (2+) 전하를 가지므로 결합하게 될 경우 Charge 가 큰 화합물이 되어, 인력이 강해진다. 따라서 F 원소와 Pb²⁺와 2A(2)족의 원소가 결합하면 물분자가 분해할 수 없는 불용성 화합물이 되는 것이다.
3. 모든 황산(SO₄²⁻) 화합물은 가용성 화합물이다.
그러나, Ca²⁺, Sr²⁺, Ba²⁺, Ag⁺, Pb²⁺ 원소와 결합한 화합물은 불용성 화합물이다. Why) 왜 그럴까?
- SO₄²⁻ 이온은 전하는 2-로 크지만, (S원소와 O원소로 이루어진) 다원자 이온이기 때문에, Size가 커서 Interaction이 낮다 -> 물분자의 인력이 SO₄²⁻ 의 이온들의 결합을 방해할 수 있기 때문에, 수용성이 된다.
그러나 SO₄²⁻ 원소에 2+ 전하를 가진 Ca²⁺, Sr²⁺, Ba²⁺, Ag⁺(는 2개가 결합), Pb²⁺ 와 결합하게 되면 매우 강한 전하를 지니게 되어, 물분자가 침투할 수 없는 불용성 화합물이 된다.
4. 모든 1A(1)족 금속이온 화합물은, 대부분 잘 녹는다.
5. NH₄⁺ 암모늄 이온은 다원자 이온인데 전하까지 1+ charge로 약하므로, Interaction이 약하니까, => 당연히 NH₄⁺이온화합물은 물분자에 의해 이온들의 인력을 침범당하는 가용성 화합물이다.
6. 모든 질산(NO₃⁻), 아세트산염(CH₃COO⁻ 또는 C₂H₃O₂⁻), 과염소산(ClO₄⁻)의 화합물들을 형태만 봐도 알 수 있듯 다원자 이온으로 Size가 크다, 그런데 charge가 1-로 매우 낮기 때문에, Interaction이 낮다고 볼 수 있다. 따라서 수용성 화합물이고 물에 잘 녹는다.
위에서 가용성 이온 결합 화합물을 모두 확인했으므로,
이제 표의 마지막 부분인 '불용성 이온 결합 화합물'에 대해 이해해보자.
1. 모든 금속 수산화(합)물(OH⁻)들은 기본적으로 불용성이다. (사이즈가 작고, Charge도 1-로 낮기 때문이다.)
그러나, 1A(1)족과 2A(2)족의 큰 이온들과 결합하면, 수용성 화합물이 된다.
2. 모든 탄산(CO₃²⁻)과 인산(PO₄³⁻) 화합물들은 전하가 크기 때문에, 사이즈 또는 전하가 작은 이온들과는 대부분 반응하여 침전물이 만들어진다. 즉, 물에는 녹지 않고 다른 이온들과 결합하여 침전물을 만들어내기에 불용성 화합물이다.
그러나 1A(1) 족, NH₄⁺ 과 반응할 때는 이온의 크기와 특성 등에 의해 수용성 화합물이 된다.
3. S²⁻ 이온은 Charge가 크기 때문에, 왠만한 금속과 반응하여 침전물을 속출시킨다. -> 불용성
그러나, 1A(1)족, 2A(2)족 NH₄⁺와 결합한 화합물은 물에 잘 녹는다 -> 수용성
Why?) 1A(1)족의 원소는 물에 잘 녹는 수화에너지가 크기 때문이고, NH₄⁺는 charge가 낮고 다원자 이온이라 Interaction이 약하기 때문이다. 2A(2)족에 대한 이유는 전하 밀도, 격제 에너지, 수화에너지 등의 이유가 있는데 뒤에서 더 자세히 배우므로 이정도로만 이해하자.
침전 형성 여부를 예측하는 과정을 요약하면 이렇다.
- 반응물에 들어 있는 이온을 확인한다 (전체 반응식으로 먼저 정리한다)
- 양이온 - 음이온 조합을 고려한다.
- 불용성 (침전을 만들어 내는) 조합을 판단한다. -> (s) 상태 표기 이 때, 주기율표를 고려해 표 4.1에서 배우고 암기해둔 것을 반영해 판단한다. -> 가용성은 (aq) 상태 표기한다.
어제 침전 반응의, 수용액에서의 기본적인 용해도 규칙 표를 상세히 해석하며 침전반응의 기본적인 논리를 이해하였다면,
오늘 공부는 침전 반응의 화학량론을 계산해보고, 산-염기 반응을 살펴보며 침전반응과는 다른 산-염기 반응을 공부하였다.
*침전 반응의 화학량론
침전 반응의 화학량론 계산은 이전에 원소의 질량을 mol 단위로 계산하고, 분자식의 몰비(당량관계)를 사용해 다른 분자(또는 원자)들의 수를 계산했다. 또한 Avogadro 수를 이용해 원자의 수까지 계산해본 것도 Ch2 ~ Ch3에 걸쳐 연습을 상당히 많이하는데, 마찬가지이다.
화학량론 계산의 핵심은, 환산인자를 잘 대입하면 된다. 어렵지 않다. 훈련이다.
4.4) 산-염기 반응
산-염기 반응의 정의와 범위는 계속 변화해왔다.
대표적으로 두 가지의 정의를 살펴보자.
1. Arrhenius 아레니우스 정리
-> 스웨덴의 화학자 스벤트 아레니우스의 정리이다.
- 산(acid) : 수용액에서 수소 이온(H⁺)을 내놓는 물질이다.
- 염기(base) : 수용액에서 수산화 이온(OH⁺)을 내놓는 물질이다.
- 산-염기 반응 : 수소 이온과 수산화 이온이 결합해, 물을 생성하는 것으로 설명.
2. Bronsted-Lowey 브뢴스테드-로우리 정리
-> 덴마크의 화학자 요한 브뢴스테드, 영국의 화학자 토마스 로우리가 함께 정리한 것이다.
- 산(acid) : 수소이온(H⁺)을 주는 물질
- 염기(base) : 수소이온(H⁺)을 받는 물질
- 산-염기 반응 : 수소 이온의 전달과정으로 설명
위의 두 가지 정의가 다르듯, 계속 변화해 온 것이다.
지금 배울 것은 1. 아레니우스 정리에 따른 산과 염기의 정의를 가지고 학습해 볼 것이다.
1. 산(acid) : 물에 녹아(수용액에서) 수소 이온 H⁺ 을 내보내는 물질
2. 염기(base) : 물에 녹아(수용액에서) 수산화 이온 OH⁺ 를 내보내는 물질
*산과 용매화된 양성자
- 산성 용액이란? : H를 가진 공유결합 분자가 물에서 이온으로 해리(분해)하여 H⁺이온을 내보낼 때 그 용액은 산성 용액이 된다.
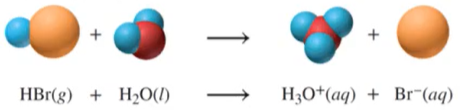
Ex) HBr 브로민화수소를 물에 용해시키면, H⁺, Br⁻ 두 개의 이온으로 분해된다.
분자 반응식으로 표현 : HBr (g) -> H⁺ (aq) + Br⁻ (aq)
위 분자 반응식에 대한 해석을 해보자
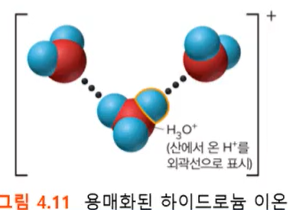
- 용매화된 H⁺ 이온은 H 원자가 하나의 양성자가 하나의 전자로 둘러 쌓인 구조이고, 따라서 H⁺ 는 양성자 그 자체이다.
- 물분자 H₂O는 (-), (+) 전하를 분자의 각 양 끝에 모두 가지고 있는 극성 분자인데, H⁺ 는 양성자이므로 물분자의 (-) 전하 부분을 강하게 끌어당긴다, 그리고 물분자와 공유결합을 형성하게 된다.
- 이렇게 용매화된 H⁺ 이온은 용매화된 H₃O⁺(하이드로늄 이온)으로 표현할 수 있게 된다.
(그림 HBr(g) + H2O(l) -> H3O+(aq) + Br-(aq) )
- 위 그림처럼, H₃O⁺는 또 다른 물 분자들과 연결되어, H₅O₂⁺, (H₂O)₂H⁺, H₇O₃⁺, H₉O₄⁺ 등으로도 형성된다. 그러나 이번 단원에서는 H₃O⁺으로만 간주하여, 표현하겠다.
=======
*전해질로서의 산과 염기
-> 앞에서 배운 내용 : 이온화합물은 물에 녹으면, 전류가 잘 통하는데, 이런 수용액을 Electrolyte(전해질)이라 부른다.
방금 배운 산과 염기. 산과 염기가 물에서 녹는 정도(해리하는 정도)에 따라 전해질의 세기가 강전해질, 약전해질과 같이 달라진다. 즉, 전류가 통하는 정도가 달라지게 된다. 물에서 잘 녹으면 강전해질, 물에서 잘 안녹으면 약전해질이 된다.

*강산, 강염기 :
- 수용액에서 이온으로 완전히(100%) 해리하는 물질이다, 완전히 해리하면 강전해질이 된다. 즉, 전류가 많이 흐르게 된다.
*약산, 약염기 :
- 수용액에서 이온으로 조금만 해리하는 물질이다. 수용액 속에서 대부분의 분자는 그대로 남는다. 따라서 약전해질이 된다. 즉, 전류가 조금 흐르게 된다.
==> 강산 (or 강염기)의 경우, 완전히 100% 해리하므로 용액 내에서 H⁺ (or OH⁻)의 몰농도와 양(mol), 각 이온의 수를 구할 수 있다. -> 이 부분은 한참 뒤인 18장에서 배운다.
=======
*산과 염기의 구조적 특징
- 산(acid) : H⁺를 가짐, 물(수용액)에서 방출됨
(강산은 완전히 방출, 약산은 조금만 방출함)
ex) NHO₃, H₂SO₄
- 염기(base) : OH⁻ or O를 가짐
ex) NaOH. K₂O -> 특히 산화이온은 불안정, 물과 반응하여 OH⁻ 이온을 형성함
* 핵심변화 : H⁺와 OH⁻ 로부터 H₂O 생성
예시를 통해 이해!
: 강산(HCl), 강염기 Ba(OH)₂ 사이의 반응 식~~
*중화반응이란?
: 산-염기 반응 중 하나로서, 산-염기 반응을 통해 물(H₂O)과 염(salt)를 생성하는 반응
"수용액상 중화 반응에서 산과 염기는 염 용액과 물을 생성한다."
ex) HX(aq) + MOH(aq) --> HX(aq) + H₂O
즉, 염의 양이온은 염기에서 나오고, 염의 음이온은 산에서 나온다.
*산-염기 반응에서의 양성자 전달
- 이 파트에서는 '양성자 전달'을 다룬다.
양성자 전달은 곧 H⁺ 이온을 전달하는 것과 동일한 의미이다.
위에서 배운 Bronsted-lowry의 산-염기정리를 이용한다.
- 산 : 양성자(H⁺)를 내주는 분자
- 염기 : 양성자(H⁺)를 받는 분자
이 의미가, 더 포괄적이고 이해하기가 쉽다.
ex) HCl 과 NaOH 반응을 살펴보자.
이 반응을 두 가지 순서로 나누어서 살펴볼 것이다.
1. HCl을 H₂O에 반응, 수용액 상태가 먼저 되고,
2. 수용액 상태에서 NaOH와 반응
1. HCl(g)는 강산이다. 따라서 H₂O에 넣으면 완전히(100%) 이온화 된다!
즉, 분자식으로 보면
HCl(g) --> H⁺ + Cl⁻
이 식에서, Cl⁻ 는 (-) charge로 불안정한 상태인데,
H₂O 분자가 극성분자로서 H원소 쪽은 (+)를, O원소 쪽은 (-) charge를 띠고 있다.
Cl⁻ 이온이 불안정한 상태는 맞지만, H₂O 분자보다는 안정적인 (-) 상태인데, 그 이유는 Cl원자의 amu는 약 35이기 때문에, 양성자가 35개, 전자가 35개 있는 상태에서 전자 하나를 잃은 상태라고 하면 비교적 인정적인 (-) 상태라고 할 수 있다.
따라서, Cl⁻ 보다 H₂O가 더 불안정하고, charge가 더 세므로 H⁺는 H₂O가 끌어당기고 Cl⁻은 끌어당기지 못한다.
따라서 아래와 같은 분자식이 완성된다.
HCl(g) + H₂O(l) --> H₃O⁺(aq) + Cl⁻(aq)
이제 두 번째 단계 : HCl이 H₂O에 녹은 상태에서 NaOH 를 반응시키기
2. HCl(g) + NaOH(aq) 반응
NaOH 는 강염기이고, OH⁻를 내놓는 물질이다.
또한 Na와 같은 1+, 2+ 인 금속은 (+)charge 를 가진 상태에서 굉장히 안정되어 있기 때문에 OH⁻가 염기로서의 역할을 할 수 있게 된다.
즉, H₃O⁺ 보다 OH⁻가 (-) 전하가 강하기 때문에, OH⁻가 H⁺ 이온을 끌어당긴다.
전체 이온 반응식은
H₃O⁺(aq) + Cl⁻(aq) + Na⁺(aq) + OH⁻(aq) --> H₂O(l) + Cl⁻(aq)+Na⁺(aq) + HOH(l) 가 된다.
구경꾼 이온은 Cl⁻(aq), Na⁺(aq) 2개이다.
또한 동시에 Cl⁻(aq)은 강산 HCl(aq)의 짝염기이고, Na⁺(aq)는 약염기 NaOH(aq)의 짝산이다. 이 둘은 반응에 전혀 영향을 주지 못하는 물질이다.
따라서 알짜 이온 반응식은
H₃O⁺(aq) + OH⁻(aq) --> H₂O(l) + HOH(l) = 2H₂O(l)
Point) 강산-강염기 사이의 수용액 반응에서 H₃O⁺이온은 산으로 작용하여 양성자를 OH⁻이온에게 내어주고, H₂O가 생성된다.
더불어, OH⁻ 이온이 H⁺를 받아들여 H₂O가 생성되는 것도 동일한 의미이다.
(자세한 내용은 심화, 18장)
아래 그림과, 그 해석으로 한번 더 이해해보자.
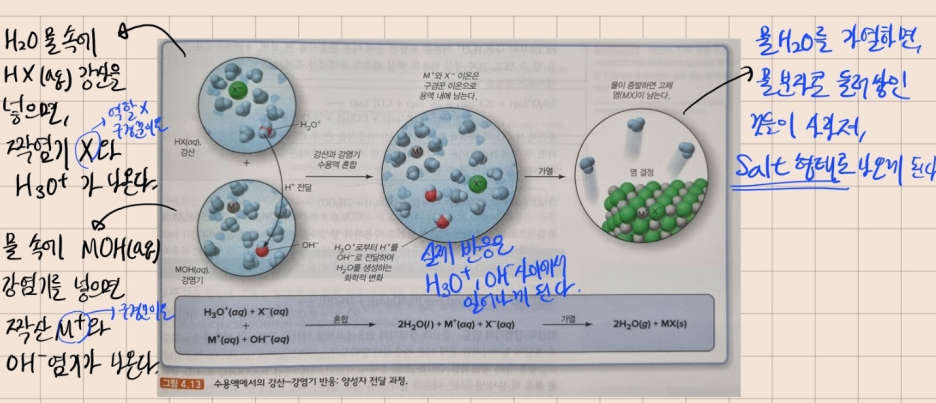
=======
*약산과 강염기의 반응
이 파트의 포인트는, 위에서 배운 강산-강염기의 반응과 비교하는 것이다.
즉, '(1) 강산-강염기 반응' 과, '(2) 약산-강염기 반응'의 전체 이온 반응식, 특히 알짜 이온 반응식이 어떻게 다른 것인지 기억하는 게 중요하다. (표 4.3 참고)
=> 강산 vs 약산이 강염기와 반응할 때의 차이 기억!
- 약한 + 강염기 반응에서는, 강염기는 모두 해리되지만, 약산은 일부만 해리된다.
다음의 반응을 살펴보며 이해해보자.
Ex) CH₃COOH(aq) + NaOH(aq) --> CH₃COONa(aq) + H₂O(l)
->여기에서, NaOH(aq)는 수산화소듐 : OH 원소를 포함한 강염기이고, CH₃COOH(aq)은 약산성이다. COOH원소를 포함한 분자는 약산성으로 이해해도 좋다.
- CH₃COOH(aq)는 약산성이므로, 해리(분해)하지 않고 분자 형태로 남아있다.
p.s) 약산 : CH₃COOH(aq) <==> H⁺ + CH₃COO⁻
- 위 식에서 <==> 는 평형상태를 의미한다, 좌에서 우 상태로, 우에서 좌의 상태로 만들어질 수 있다는 의미이다.
- CH₃COO⁻ 가 양성자를 공격할 (=H⁺ 를 끌어당긴다는 뜻) 수 있다, 따라서 다시 좌측의 상태로 돌아갈 수 있다.
- CH₃COO⁻는 아세트 이온으로, 염기성이 물보다 강하다(=음전하를 더 크게 띤다), 그래서 일부 아세트산을 만든 상태로 수용액 내에 존재하게 된다.
- 하지만, 아세트산CH₃COOH(aq) 대부분은 물에서 녹아 아래의 분자식 상태를 일반적으로 사용한다.
CH₃COOH(aq) + H₂O --> H₃O⁺ + CH₃COO⁻
사족이 길었다. 다시, CH₃COOH(aq) + NaOH(aq) --> CH₃COONa(aq) + H₂O(l) 분자식의 전체 이온 반응식 (모든 이온으로 풀어서 쓴 화학식) 을 써보자.
CH₃COOH(aq) + Na⁺(aq) + OH⁻(aq) --> CH₃COO⁻(aq) + Na⁺(aq) + H₂O(l)
- 전체 이온 반응식을 살펴봤을 때, Na⁺(aq)가 구경꾼 이온이라는 것을 확인할 수 있다.
이제 알짜 이온 반응식(전체 이온 반응식에서 구경꾼 이온을 제거한 식)을 살펴보자.
CH₃COOH(aq) + OH⁻(aq) --> CH₃COO⁻(aq) + H₂O(l)
- 이 식의 좌측 화학식에서 CH₃COOH(aq)의 H⁺ 이온이 OH⁻(aq)으로 전달되어, 우측 화학식의 H₂O(l) 가 생성된다.
- CH₃COO⁻(aq) 는 아세트 이온으로, 구경꾼 이온이라 착각해서는 안된다. 양변에 동일하게 없기 때문이고, 반응에 참여한 아주 당당한(ㅋㅋ) 물질이다.
Point) 약산과 강염기의 일반식(=일반적인 알짜 반응식)
HX(aq) + OH⁻(aq) --> X⁻(aq) + H₂O(l)
- 여기서 HX(aq)는 어떠한 약산 물질을 의미한다. (하지만 교수님 피셜, 약산을 의미할 때는 약산의 대표적인 물질 F 를 사용해 HF로 적는게 더 좋은 표현이라고 하심, X는 할로겐족을 나타낼 때 많이 표현한다고 한다.) 이 약산 HX가 OH⁻(aq)와 반응하여, H₂O(l)를 생성한다. 동시에 약산의 짝염기라고 부를 수 있는 X⁻(aq)도 생성하게 된다.

표4.3)을 통해, 강산과 강염기, 약산과 강염기 두 반응의 반응식 차이를 살펴보자.
핵심은, 알짜 이온 반응식 부분에서
<강산과 강염기 반응식>의 알짜 이온 반응식은 항상 동일하지만,
<약산과 강염기 반응식>에서는
- 1. 약산을 그대로 써주고, 2. 약산이 해리되어 이온화된 짝염기를 써주며, 3. 생성된 물을 적어준다 는 차이가 있다. -
=======
*산-염기 반응의 화학량론 : 산-염기 적정
- 산-염기 반응의 특징은, H⁺ 의 이동이 매우 빠르다는 점에 있다. => 화학 반응에서 속도가 매우 빠른 종류 중 하나이다.
Tip) 산-염기 반응의 화학량론을 계산할 때는, 당량비(몰비)만 잘 따지면 금방 계산을 잘 할 수 있다.
즉, 이번 part에서는 산-염기 반응에서의 화학량론을 계산하는 부분이다. 어렵지 않다.
* 적정(titration)을 이용한 산-염기 반응의 정량
먼저, 단어를 정리하자.
- 적정 : 산-염기 반응을 이용하여 정량하는 과정
- 산-염기 지시약(indicator) : 산성 용액과 염기성 용액에서 서로 다른 색을 내는 물질

위 그림에서, 각 그림별로 특징을 설명하겠다.
A. 미지의 샘플 수용액이 플라스크에 들어가 있다. 이 내부에 특정 산이 들어가 있다.
이 특정 산의 농도를 알기 위해, 농도를 알고 있는 OH⁻를 넣는다. 플라스크 위의 긴 막대기 : 뷰렛(burette)에 있는 물질이 OH⁻이다. 이 물질을 플라스크 내부에 조금씩 추가한다. (OH⁻의 처음 뷰렛에서의 부피와, 추가한 이후의 부피를 가지고 들어간 양을 계산해야한다)
B. 당량점 상태에 있다가, OH⁻ 이온이 많아지기 시작하는 시점이다.
- 당량점(equivalence point) : 초기 산성 내에 있던 H⁺ 이온과 첨가된 OH⁻의 양(mol)이 같아질 때 => 눈으로 확인하기 위해 '지시약'을 사용한다.
- 종말점(end point) : 지시약이 변하는 시점을 의미, OH⁻ 이온의 양이 H⁺보다 많아지기 시작할 때, 지시약은 변색한다. (H⁺ 이온과 첨가된 OH⁻의 양(mol)이 같아질 때도 변색하거나 변색하지 않을 수 있는데, 이후 OH⁻가 많아지면 또 다른 색이나 새로운 색으로 변색한다는 의미이다)
C. 종말점 상태로, OH⁻가 H⁺이온보다 더 많다.
=======
4.5) 산화-환원 반응
(Oxidation-reduction(redox) reaction)
=> 태양광 전지, 베터리 등에서 주로 일어나는 반응이므로, 매우 중요하다고 볼 수 있다.
*핵심 변화 : 반응물 사이의 전자 이동
Point) 전자들의 알짜 이동!이 이 Part에서의 핵심이다!
① 이온 결합 화합물 : 전자 전달(electron transfer)
ex) MgO 형성 반응
: 2Mg(s) + O₂(s) -> 2MgO(s)
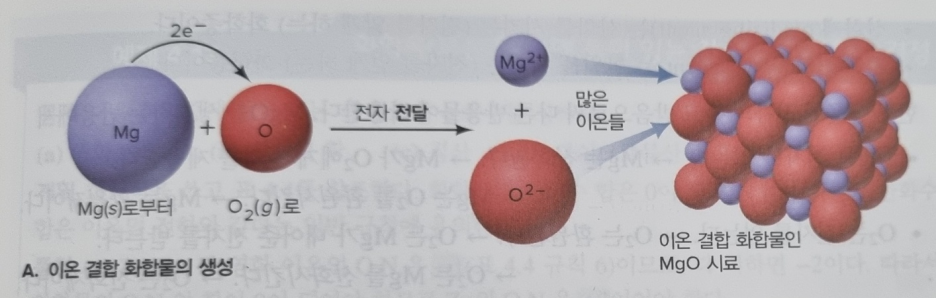
(사진 부연 설명)
Mg는 2+, O₂는 -2 x 2 = 4의 charge를 가짐.
전자는 + -> - 으로 이동하므로 (인력이 더 큼), O원자는 -2가 Mg의 전자 2개를 가져가게 됨 (2e⁻ 이동으로 표현 가능)
-> 각 Mg 원자로부터 각 O원자로의 "전달(transfer)"이라 한다.
=> Mg²⁺와 O²⁻ 이온들이 모여, '이온결합고체'를 형성한다
p.s) 반응식에서 2Mg 반응식의 균형(생성물의 전하가 0이 되어야 하므로)을 맞추기 위함.
But, Mg분자는 Mg원자 1개로, O₂분자는 O원자 2개로 이루어짐. Mg -> O₂로 전자가 이동하는 것!
② 공유 결합 화합물 : 전자 이동(Shift of election)
ex) HCl 기체 생성 반응
: H₂(g) + Cl₂(g) --> 2HCl(g)
H가 +1, Cl은 -1의 charge를 가짐, -> 반응식에서 원자가 2개씩 이므로, 전하량은 같음.
(-)가 (+)의 전자를 끌어가려는 성질이 있으므로,
H에서 Cl으로 전자가 이동하게 됨, 그리고 전자를 나누어 가짐(공유결합이니까)
(하지만 사실, 전자가 이동한다는 개념은 화학계에서도 논란이 있음, 그러나 이번에 배울 때는 이동+공유 개념으로 배우자)
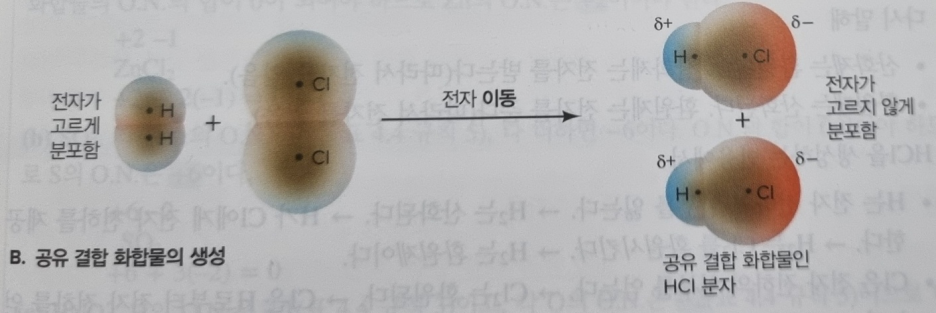
(사진 설명)
즉, 공유결합에서는 극단적으로 전자를 줬다(=이동했다)라고 가정하고, 이를 전자를 공유한 상태라고 보며, '산화-환원'으로 보기로 하였다.
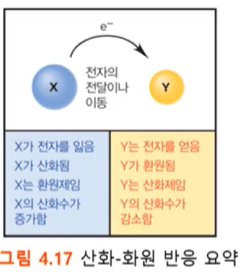
=======
*필수 용어
- 산화(oxidation) : 전자를 잃는 것
- 환원(reduction) : 전자를 얻는 것
ex)
Mg(s) + O₂(g) -> MgO
- Mg(s) : 산화 = 전자를 잃음 = 자신이 산화됨
- O₂(s) : 환원 = 전자를 얻음 = 자신이 환원됨
- 산화제(oxidizing agent) : 산화를 시키는 (전자를 잃게 하는) 화학종
- 환원제(reducting agent) : 환원을 시키는 (전자를 얻게 하는) 화학종
위의 Mg + O -> MgO 반응에서,
Mg가 환원제 : 환원제는 산화된다.(=전자를 잃는다)
O가 산화제 : 산화제는 환원된다.(=전자를 얻는다)
ex)
H₂(g) + Cl₂(g) -> 2HCl(g) 에서는,
- H : 전자 일부를 잃음(이동)
= 산화된다.
= H가 Cl에게 전자 전하를 전달(제공)한다.
= H₂는 Cl₂를 환원시킨다.
- Cl : 전자 일부를 얻음
= 환원된다.
= Cl은 H로부터 전자 전하를 얻는다.
= Cl₂는 H₂를 산화시킨다.
= Cl₂는 산화제이다.
=======
Note) 이온전하와 산화수 표기법
- 이온전하 : 2+, 2- (부호를 뒤에 씀, 1은 생략)
- 산화수 : +2, -2 (부호를 앞에 씀, 1은 그대로 씀)
*산화수를 이용하여 전자 전하 추적하기! (매우 중요한 파트)
-> 원자들의 산화수를 보고, 산화 or 환원된 물질을 예측하는 방법!
- 산화수 (oxidation number, O.N.)
: 전자가 완전히 이전될 때(가정), 원자가 가질 것으로 예상되는 전하를 의미
--> 이성분 이온결합 (ex : MgO, 2HCl 등)은 산화수가 곧 이온전하와 같다.
그러나, 다원자 이온결합(공유결합 화합물)의 각 원소는, 전자가 이동하므로 부분 전하를 갖는다.
=> 규칙에 따라 산화수가 정해진다.
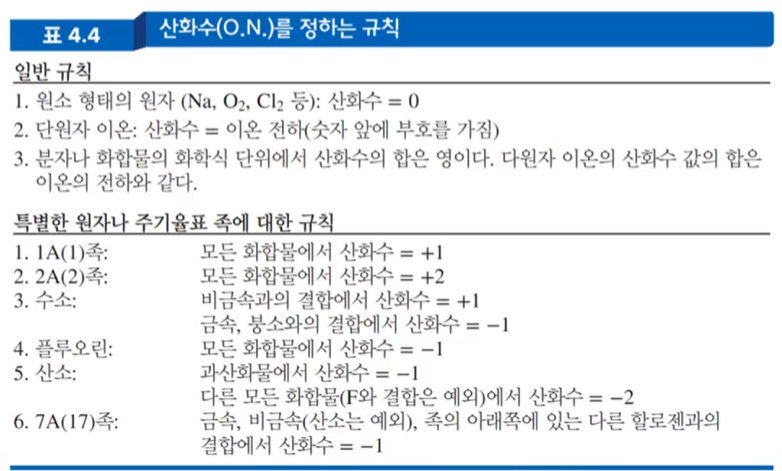
(표 4.4)
(표의 규칙을 활용한 산화수 추적 예시)
1. 일반규칙 1번+특별규칙 3번 :
NaH -> Na 가 +1 금속, H는 -1 비금속
-> 산화수 :
+1 -1
Na H
+1 -1 = 0
2. 특별규칙 3번 :
H₂O -> H는 O가 비금속이므로 +1, H₂가 +2, O는 -2
-> 산화수 :
+2 -2
H₂ O
+2(+1) -2 = 0 : (+1)은 H의 산화수를 표기한 것
3. 특별규칙 5번 = 산소계 + 특별규칙 3번(H)
H₂O₂ -> H는 O₂가 비금속이므로 +1
O₂ -> 과산화물이므로 산화수 -1
(과산화물 = 산소 O가 2개 이상 포함된 화합물)
-> 산화수 :
+2 -2
H₂ O₂
(+1)2 + (-1)2 = 0
=======
*산화-환원 반응에서의 화학량론 : 산화-환원 적정
=> 산-염기 반응에서 화학량론을 알아낼 때, 알려진 농도의 염기를 활용해 -> 산의 미지의 농도를 알아낸 것처럼,
농도를 알고 있는 산화제(또는 환원제)를 사용 -> 농도를 모르는 환원제(또는 산화제)의 농도를 알아낸다.
ex) 과망간산 이온(MnO₄⁻)으로 옥살산 이온(C₂O₄²⁻) 적정 MnO₄⁻ 이온이 엷은 분홍색을 띰!
- 알짜 이온 화학식이 주어짐 (실제 산화-환원 반응 화학식을 짜는 것은 매우 어렵, 일반화학 수준에서는 화학식이 주어짐)
2MnO₄⁻(aq) + 5C₂O₄²⁻(aq) + 16H⁺(aq) --> 2Mn²⁺(aq) + 10CO₂(g) + 8H₂O(l)
위 적정의 핵심은,
Na₂C₂O₄ 의 용액의 부피, KMnO₄ 용액의 농도와 부피를 알고 있으므로 -> C₂O₄⁻ 의 농도를 계산해내는 것!
=======
4.6) => 생략
=======
4.7) 반응의 가역성과 평형 상태
중요 개념 : 동적평형(dynamic equilibrium)
=> 정반응과 역반응이 빠르게, 동시에 일어난다는 개념
그러나. 반응물과 생성물은 더 이상 변하지 않고, 혼합물 상태로 존재한다.
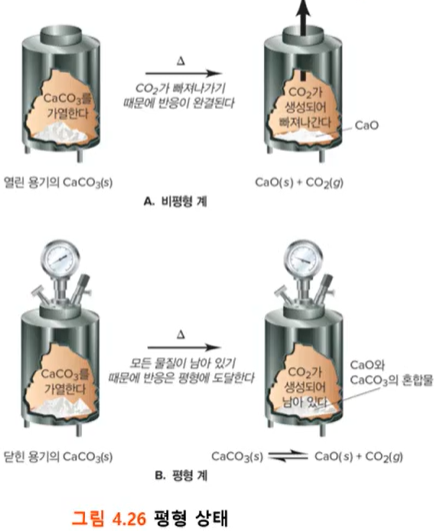
(그림 4.26 설명)
A. 비평형계 : 위쪽이 열린 관
- CaCO₃(s)를 가열하면, CaO(s) + CO₂(g)로 분해된다. 분해 후, CO₂(g)는 가스상태로 날라간다.
- CO₂(g)가 날라가 '역반응은 불가능'하다.
(역반응 : CaO(s) + CO₂(g) -> CaCO₃(s) 가 생성되는 반응)
B. 평형계 : 닫힌 관
- CaCO₃(s) 를 가열 -> CaO(s) + CO₂(g)로 분해 : 정반응,
- 다시 CaO(s) + CO₂(g) 가 -> CaCO₃(s)로 생성 : 역반응,
=> 정반응과, 역반응이 반복되다가, 두 반응의 이뤄지는 속도가 비슷해질 때까지 계속 빨라짐, 결국 CaO(s), CO₂(g), CaCO₃(s) 세 가지 물질의 양이 변하지 않고 '평형상태'를 유지하게 된다.
Point) 평형 상태를 통해 알 수 있는 핵심은,
거시적으로는 농도가 일정한 혼합물의 상태일지라도,
미시적(분자 수준)으로는 정반응과 역반응이 비슷한 속도로 계속 일어나는 것이 바로 평형상태가 되는 것이다.
'일반화학' 카테고리의 다른 글
| [일반화학] AI 를 활용한 공부 (Ch4. 세 종류의 주요 화학반응) (0) | 2024.09.01 |
|---|
